台康生生物相似藥 解盲達標
送美、歐、台申請藥證,拚2022年底取證,2023年初前完成認列總授權金15億
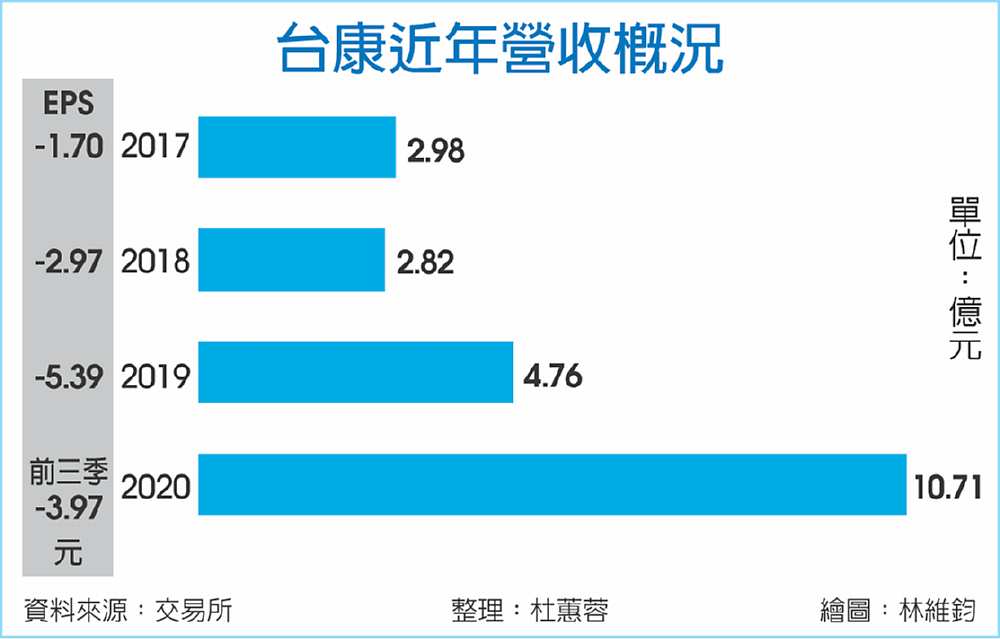
台康生(6589)23日宣布,旗下乳癌生物相似藥EG12014人體臨床三期試驗,數據分析結果達到生物相等性標準,後續將依時程規畫進行美國FDA的BLA、歐盟EMA的MAA及台灣衛福部食藥署等全球送件申請,預計最快2022年底可望取得藥證。
由於台康生2019年4月已與國際藥廠Sandoz AG簽訂乳癌生物相似藥EG12014授權合約,簽約金及里程碑金額總計達7,000萬美元,銷售地區涵蓋除台灣、大陸以外的全球市場。截至去年底,台康生已認列台幣5.3億元階段里程金。
法人初估,因解盲達標,台康生今年可望再認列超過4億元,為營運吃下大補丸,預計2023年初前完成認列總授權金15億元,藥物上市後,該公司也將享有銷售分潤。
台康生的EG12014相似藥三期臨床是一個多國多中心、隨機、雙盲試驗,主要是證明EG12014和原廠羅氏(Roche)藥物賀癌平(Herceptin)在早期 Her2陽性乳癌病人治療結果的等效性,並同時比較兩個trstuzumab產品的安全性、免疫反應及藥物動力。該試驗共收案807位受試者。
台康生總經理劉理成表示,臨床數據分析結果顯示,EG12014與 Herceptin的風險比及慨率差異均落在預設區間內,且數據極為靠近中間區間範圍,證明了EG12014已達與HerceptinR的療效相等性,同時由這兩組臨床的數據分析亦顯示EG12014與HerceptinR的安全性也是相當的。
依據原廠羅氏去年銷售數據,Herceptin全球銷售額達37.3億瑞士法郎,美國及歐洲市場銷售額分別為13.6億與6.7億瑞士法郎,相較於 2019年衰退34%,主要是因2018年中生物相似藥開始進入歐洲及日本市場、及2019年生物相似藥也正式進入美國市場所影響。
台康生開發的EG12014在美國、歐洲、韓國、印度等全球11個國家進行三期臨床試驗,此次解盲數據達標後,後續將申請藥證且採滾動式審查,目標2022年下半年取得藥證。
劉理成指出,乳癌原廠藥為羅氏的賀癌平(Herceptin),年生產量約1,100公斤,台康生目前產能已可生產1,000公斤。
